- Çağla Görkem Eroğlu ,
- Alexandra A. Bennett ,
- Thérèse Steininger-Mairinger ,
- Stéphane Hann ,
- Markus Puschenreiter ,
- Judith Wirth et
- Aurélie Gfeller
Rapports scientifiques volume 14 , Numéro d’article : 8679 ( 2024 )
Les racines sont cruciales dans l’adaptation des plantes par l’exsudation de divers composés qui sont influencés et modifiés par des facteurs environnementaux. L’exsudat racinaire du sarrasin et la réponse du système racinaire aux plantes voisines (sarrasin ou amarante à racine rouge) et la manière dont ces exsudats affectent l’amarante à racine rouge ont été étudiés. La caractérisation des exsudats racinaires dans les interactions plante-plante présente des défis, c’est pourquoi un système racinaire divisé qui a permis l’application de traitements différentiels à des parties d’un seul système racinaire et un échantillonnage non destructif a été développé. Le profilage du métabolome non ciblé a révélé que la présence et l’identité des voisins induisent des changements systémiques. La présence de voisins du sarrasin et de l’amarante à racine rouge a régulé à la hausse 64 et 46 métabolites, respectivement, avec un chevauchement de seulement 7 métabolites. L’analyse de la morphologie des racines a montré que, tandis que la présence d’amarante à racine rouge diminuait le nombre d’extrémités de racines chez le sarrasin, le sarrasin diminuait la longueur et le volume totaux des racines, la surface, le nombre d’extrémités de racines et les fourches de l’amarante à racine rouge. Le traitement avec des exsudats (provenant des racines de sarrasin et d’amarante à racine rouge en étroite interaction) sur l’amarante à racine rouge a diminué la longueur totale des racines et le nombre de fourches des semis d’amarante à racine rouge par rapport aux témoins. Ces résultats permettent de comprendre comment les plantes modifient la composition de leurs exsudats racinaires en présence de voisins et comment cela affecte les systèmes racinaires des autres.
Contenu similaire consulté par d’autres

Composition de l’exsudat racinaire des espèces de graminées et de plantes herbacées dans les prairies naturelles
Article Accès libre01 juillet 2020

La composition de l’exsudat racinaire reflète le gradient de gravité de la sécheresse chez le grama bleu ( Bouteloua gracilis )
Article Accès libre22 juillet 2022

Le métabolisme de base et la dynamique d’exsudation racinaire de trois espèces végétales phylogénétiquement distinctes
Article Accès libre24 mars 2023
Introduction
Français Les racines des plantes s’adaptent et font face aux modifications des conditions environnementales ; leurs schémas de croissance et de distribution spatiale changent en présence d’autres plantes. Les recherches antérieures sur les interactions entre plantes souterraines et la détection des voisins se sont principalement concentrées sur celles qui se produisent passivement par le biais de modifications de l’environnement et de fluctuations de la disponibilité des ressources, telles que la lumière, les nutriments et l’eau, qui sont déterminées par la présence de plantes voisines et la concurrence 1 , 2 , 3 . Ces signaux et réponses physiques sont largement étudiés ; on sait que les plantes ont la capacité d’utiliser les ressources et d’épuiser l’environnement partagé, affectant par conséquent la croissance, le développement et la survie de leurs voisins. Cette compétition physique, en plus de la communication chimique rhizosphérique, permet à certaines plantes connues sous le nom de cultures de couverture de supprimer naturellement les mauvaises herbes dans les milieux agricoles 4 , 5 , 6 .
Cependant, un débat s’est développé dans la littérature sur cette communication rhizosphérique pour savoir si les plantes ont une reconnaissance de soi et de non-soi souterraine et a tenté de conceptualiser cette interaction avec plusieurs termes et définitions 7 , 8 . Les interactions racine-racine peuvent se produire soit de manière interspécifique, entre les membres de différentes espèces de plantes, soit de manière intraspécifique, au sein des individus de la même espèce 3 , 9 , 10 . Comme les changements dans la morphologie des racines peuvent varier en fonction des conditions environnementales, il est difficile de conclure à la ou aux réponses générales causées spécifiquement par leurs voisins 11 , 12 . Bien qu’il soit difficile d’analyser ce qui cause ces réponses, il existe de plus en plus de preuves que les plantes génèrent et utilisent activement la signalisation chimique en produisant des exsudats racinaires et des composés organiques volatils qui affectent d’autres organismes, y compris les plantes voisines, à leur proximité 13 , 14 , 15 , 16 .
Ces exsudats racinaires peuvent être classés en métabolites primaires (par exemple, acides aminés, sucres et acides organiques) directement impliqués dans la croissance et le développement, et en métabolites spécialisés (par exemple, composés phénoliques, terpénoïdes) impliqués dans des fonctions telles que la défense et l’attraction. Alternativement, ils peuvent être distingués en trois groupes selon leur poids moléculaire en composés de faible poids moléculaire (acides aminés, acides organiques, sucres, composés phénoliques et une grande variété de composés secondaires), composés de poids moléculaire élevé (polysaccharides et protéines) et ions. Les exsudats peuvent être libérés via différents mécanismes tels que la sécrétion, la diffusion (composés de faible poids moléculaire) et l’excrétion (par exemple, le mucilage) 17 , 18 , 19 , 20 , 21 . La concentration et la composition des exsudats racinaires dépendent de nombreux facteurs tels que l’espèce végétale et les facteurs abiotiques et biotiques, y compris la communauté microbienne et végétale présente 22 , 23 . Français Une fois libérés dans l’environnement du sol, les exsudats racinaires peuvent (i) influencer directement le métabolisme des espèces voisines, (ii) être consommés, dégradés ou transformés par les plantes ou les micro-organismes du sol et/ou (iii) modifier les propriétés physiques et chimiques du sol 20 , 24 , 25 , 26 . Certains composés bien étudiés sont connus pour avoir des effets inhibiteurs sur la germination et la croissance d’autres espèces végétales 27 , tels que les momilactones dans le riz 28 , 29 , les benzoxazinoïdes dans les céréales comme le seigle 25 , 30 , le blé 31 et le maïs 32 , l’hordénine et la gramine dans l’orge 33 et la sorgoléone dans le sorgho 34 .
Bien que certains composés présents dans les exsudats racinaires aient été isolés et bien identifiés, il s’est avéré difficile de caractériser spécifiquement la composition modifiée des exsudats racinaires en réponse à une plante voisine lorsque plusieurs espèces de plantes sont cultivées ensemble. Les systèmes à racines divisées nécessitent la division d’un système racinaire de plante en plusieurs compartiments. Cela permet l’application de traitements différentiels à chaque compartiment (par exemple, des plantes voisines différentes peuvent être présentes ou absentes dans chaque compartiment). Il existe différentes manières de mettre en place un système à racines divisées en fonction de facteurs tels que l’objectif de l’étude, l’âge de la plante requis pour le traitement et/ou le type de plante et son système racinaire 35 , 36 . Français La disponibilité de techniques aussi diverses pour établir des systèmes racinaires divisés chez différentes espèces de plantes tout en traitant différemment des parties uniformément divisées d’un même système racinaire est utile pour divers sujets de recherche (par exemple, l’absorption et le transport des nutriments par les plantes 37 , 38 , 39 , le stress abiotique et biotique 40 , 41 , 42 , 43 , la signalisation hormonale 44 , 45 , 46 et les symbioses avec les microbes du sol 47 ). De plus, les systèmes racinaires divisés sont un outil utile dans les études d’interaction racine-racine des plantes. Il permet à la moitié du système racinaire d’être exposée aux racines d’un voisin tandis que l’autre moitié ne l’est pas. Ce système permet d’isoler et d’évaluer les exsudats d’une seule espèce de plante lorsqu’elle est cultivée en présence d’une autre. Une recherche approfondie de la littérature pertinente indique qu’il s’agit de la première étude sur les interactions racinaires divisées du sarrasin au moment de la publication.
Le sarrasin (BK) ( Fagopyrum esculentum Moench) appartient à la famille des Polygonacées et forme une racine pivotante avec un système racinaire dense 48 . Les cultures de couverture telles que le BK sont utilisées en agriculture pour leurs multiples services écosystémiques tels que la réduction de l’érosion du sol, l’amélioration des propriétés du sol, l’attraction des pollinisateurs/insectes bénéfiques et la suppression des mauvaises herbes 49 , 50 , 51 . Les mauvaises herbes provoquent des pertes de rendement substantielles 52 et l’utilisation d’herbicides pour la gestion des mauvaises herbes n’est ni durable ni respectueuse de l’environnement en raison de la résistance et de la toxicité des herbicides. Par conséquent, il est pertinent de réduire l’utilisation d’herbicides et d’exploiter tous les niveaux de gestion intégrée des mauvaises herbes 53 . Les cultures de couverture peuvent supprimer les mauvaises herbes indirectement par la compétition pour les ressources et directement en libérant des composés. Dans des études précédentes, le BK a montré des effets suppresseurs sur la croissance de l’amarante à racine rouge (P) ( Amaranthus retroflexus L.), une espèce de mauvaise herbe dicotylédone gênante originaire d’Amérique du Nord et actuellement distribuée presque partout dans le monde. Français La suppression de la croissance observée était due à la fois à l’ombrage et aux interactions racine-racine 27 , 54 , 55 . Cependant, dans les essais sur le terrain, l’effet d’ombrage du BK n’était pas le principal facteur suppresseur de croissance pour P 56 . Des études réalisées à partir d’analyses métabolomiques ciblées ont montré que le BK produit de nombreux flavonoïdes et composés phénoliques, tels que la (+)-catéchine, la 4-hydroxyacétophénone, l’acide vanillique et l’acide gallique, qui présentent des effets inhibiteurs sur diverses espèces de mauvaises herbes 57 , 58 , 59 .
Bien que de nombreuses études effectuent une métabolomique ciblée pour identifier des composés connus avec un niveau de certitude élevé, une approche d’analyse non ciblée (NTA) présente l’avantage de récupérer autant de signaux chimiques pertinents que possible à partir d’un échantillon. Cela permet la découverte de composés nouveaux, souvent inconnus, qui n’étaient pas pris en compte auparavant et la description de changements complexes dans les profils d’exsudats de nombreux composés 60 . Cependant, il n’est pas possible de générer des informations précises sur la quantification absolue et le profil de fragmentation de tous ces composés au cours de l’analyse NTA 61 . C’est pour cette raison que l’analyse NTA est considérée comme un outil exploratoire qui bénéficie d’une analyse ciblée de suivi pour validation 62 .
Avec l’intérêt d’utiliser une approche NTA pour explorer la dynamique de communication plante-plante souterraine, nos objectifs étaient : (i) d’étudier si BK perçoit la présence de voisins intra- (BK) et interspécifiques (P) à travers des systèmes racinaires en interaction et modifie systématiquement sa composition d’exsudats racinaires, ainsi que l’architecture du système racinaire ; (ii) de déterminer si ces changements dans les exsudats racinaires sont propres aux espèces testées et/ou sont une réponse générale à la présence de l’une ou l’autre des plantes voisines ; et (iii) d’évaluer les effets des exsudats racinaires obtenus à partir de l’interaction de BK avec des voisins sur l’architecture du système racinaire P. Pour atteindre ces objectifs, nous avons développé un système racinaire divisé BK (Fig. 1 ) et un test biologique permettant respectivement la collecte d’exsudats racinaires et l’application d’exsudats racinaires sur P. Dans une approche de criblage non ciblée, les exsudats ont été analysés chimiquement à l’aide de la chromatographie liquide à ultra-haute performance (UHPLC) couplée à la spectrométrie de masse à haute résolution (HRMS) et analysés statistiquement pour évaluer les composés exprimés différentiellement.

Résultats
Profilage métabolomique non ciblé des exsudats racinaires
Normalisation
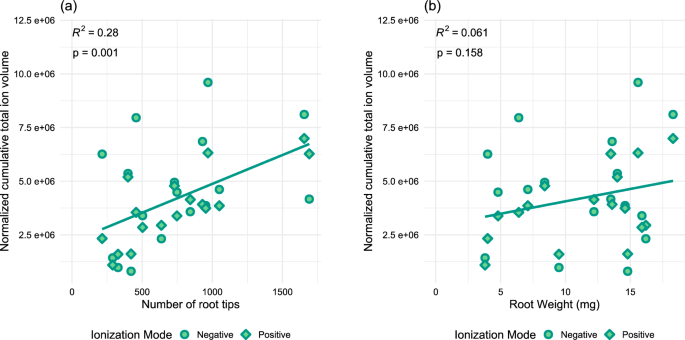
Le poids sec des racines est le paramètre le plus fréquemment utilisé pour la normalisation dans les études sur le métabolisme racinaire 63 , 64 . Cependant, il n’existe aucune preuve dans la littérature qu’une biomasse racinaire sèche plus élevée soit nécessairement liée à une exsudation racinaire plus élevée. Par conséquent, nous avons comparé le poids sec des racines et le nombre d’extrémités racinaires et avons postulé que si l’exsudation racinaire a lieu principalement aux extrémités racinaires 11 , alors le nombre d’extrémités racinaires pourrait être un meilleur paramètre pour la normalisation biologique.
Les deux paramètres biologiques ont été corrélés avec le signal composé total cumulé (TCS). La corrélation entre le nombre d’extrémités racinaires et le TCS cumulé (Fig. 2 a, R 2 = 0,28, p = 0,001) était plus forte que la corrélation entre le poids des racines et le TCS cumulé (Fig. 2 b, R 2 = 0,061, p = 0,158). Par conséquent, au lieu du poids des racines, le nombre d’extrémités racinaires a été utilisé pour la normalisation.
Réduction dimensionnelle et analyse statistique multivariée des métabolites
La distribution des données au sein du groupe des TCS cumulés d’exsudats racinaires des compartiments A des trois conditions de racines divisées qui contiennent seulement la moitié des systèmes racinaires BK sans voisin (BK-0/A), un voisin homospécifique (BK-BK/A) et un voisin hétérospécifique amarante à racine rouge (BK-P/A) a été comparée (Fig. 3 a) pour voir s’il y avait des changements importants dans l’exsudation racinaire totale. La variation des données a été expliquée par les traitements lors de l’analyse avec une ANOVA de Welch (valeur p = 0,033) en mode d’ionisation positive, mais la signification a été perdue après avoir effectué un test post-hoc T3 de Dunnett modifié pour utiliser BK-0/A comme groupe témoin. À ce stade, aucune différence définitive entre ces groupes n’a pu être observée.

Une analyse multivariée a été réalisée pour évaluer la perception des voisins intra- (BK) et interspécifiques (P) par BK. Une analyse en composantes principales (ACP) des signaux TCS utilisant 3 composantes met en évidence plusieurs résultats clés (Fig. 3 b). L’ACP tridimensionnelle a pu expliquer environ 70 % de la variance dans les données. Les échantillons QC se sont regroupés ; cela a validé les pipelines d’acquisition et de traitement des données. Les échantillons P se sont clairement séparés des échantillons BK. BK-BK/A se chevauchait avec toutes les autres conditions BK. Enfin, les échantillons BK et BK-0/A se sont regroupés les uns à côté des autres, indiquant que les échantillons étaient similaires les uns aux autres et que le système à racines divisées à lui seul n’a pas induit de changements majeurs dans le profil des métabolites. Étant donné que les diagrammes en boîte et à moustaches TCS cumulatifs et l’analyse ACP n’ont pas pu visualiser beaucoup de différences entre les compartiments A des trois conditions à racines divisées, une méthode de réduction de dimension supervisée, l’analyse discriminante des moindres carrés partiels (PLS-DA), a été utilisée pour visualiser une éventuelle différence dans l’exsudation des racines. Les trois groupes se sont séparés avec le PLS-DA, indiquant qu’il y avait des différences de nuances entre les groupes (Fig. 3 c).
Évaluation univariée des métabolites individuels
Pour évaluer quels métabolites étaient spécifiquement différents entre les groupes, des statistiques univariées ont été réalisées sur 597 composés en mode d’ionisation négative et 689 en mode d’ionisation positive. En comparant les compartiments A des trois conditions de racines fendues, aucun métabolite n’a été exsudé davantage par le sarrasin cultivé sans voisin (BK-0/A) par rapport à un voisin sarrasin (BK-BK/A) et/ou un voisin amarante à racine rouge (BK-P/A). Cependant, la présence d’un voisin a augmenté ou induit la production de certains métabolites. Par rapport à BK-0/A, 64 métabolites ont été régulés à la hausse dans BK-BK/A (Fig. 4 a et Tableau S1 a) et 46 métabolites ont été régulés à la hausse dans BK-P/A (Fig. 4 b et Tableau S1 b). La présence d’un voisin sarrasin (BK-BK/A) a entraîné une régulation à la hausse de plus de composés par rapport à un voisin amarante à racine rouge (BK-PA). Ceci est indiqué par l’expression significativement élevée de 29 métabolites dans BK-BK/A par rapport à BK-P/A (Fig. 4 c et Tableau S1 c).
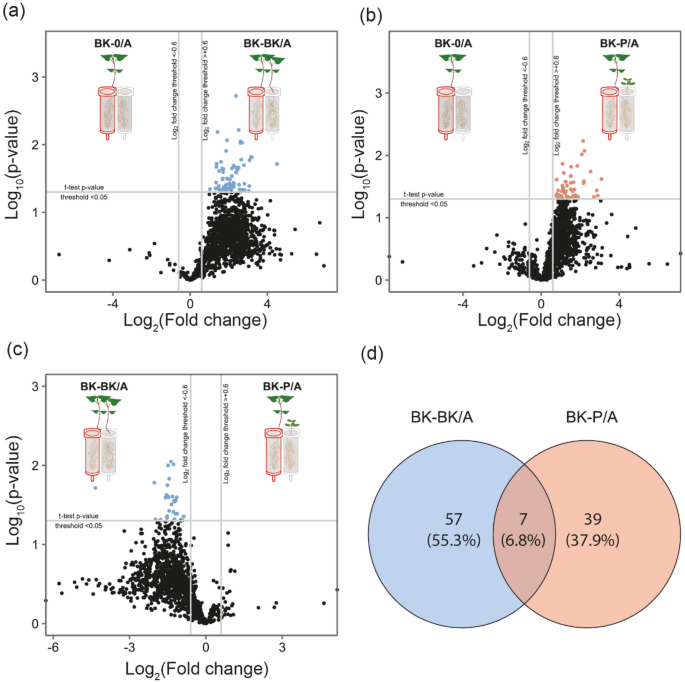
Un diagramme de Venn a été utilisé pour montrer le nombre de composés régulés positivement de manière unique par la présence de chaque voisin par rapport à BK-0/A (Fig. 4 d) afin de déterminer si la régulation positive est une reconnaissance spécifique à l’espèce et/ou une réponse générale. Bien qu’il y ait eu un certain chevauchement (~ 7 % des 103 métabolites régulés positivement par BK-0/A), ~ 55 % des métabolites régulés positivement étaient uniques à BK-BK/A et ~ 38 % étaient uniques à BK-P/A.
Les composés spécifiques à l’espèce présentaient également un intérêt. Par exemple, le métabolite inconnu 813 de la BK (mode d’ionisation = positif, m/z = 327,1049, RT = 10,45) de la Fig. S2 a, bien que non significativement différent pour toutes les conditions de BK par rapport à P, est significativement différent entre la BK non divisée cultivée seule et la P cultivée seule. Cependant, les métabolites exclusifs à P étaient généralement exprimés en abondance beaucoup plus élevée et plus faciles à annoter statistiquement. Par exemple, le métabolite inconnu 341 (mode d’ionisation = positif, m/z = 203,0810, RT = 4,02) présenté dans la Fig. S2 b est significativement (Games-Howell p < 0,05) plus élevé dans les conditions BK-P/B et P par rapport à toutes les autres conditions.
Les composés identifiés au niveau de confiance 1 selon l’échelle Schymanski 65 utilisant les normes d’exsudats racinaires factices sont présentés dans le tableau S2 . Trois de ces composés identifiés, la tyrosine, le tryptophane et la phénylalanine, étaient trois des 64 composés régulés à la hausse par la présence d’un voisin BK (BK-BK/A) par rapport à l’absence de voisin (BK-0/A).
Analyse de la morphologie des racines
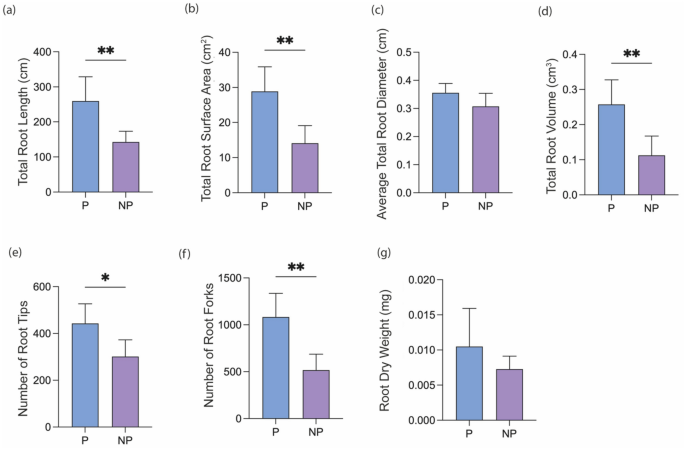
Parmi les paramètres racinaires BK comparés entre les compartiments A des conditions de racines divisées (BK-0/A, BK-BK/A et BK-P/A) (Fig. 5 a, c, e, g, i, k, m), seul le nombre d’extrémités racinaires a diminué de manière significative dans BK-BK/A et BK-P/A par rapport à BK-0/A. Le nombre d’extrémités racinaires dans BK-BK/A était inférieur à celui dans BK-P/A.

Lorsque les compartiments A et B de BK-P ont été comparés, des différences significatives ont été observées dans de multiples paramètres racinaires : la longueur totale des racines (Fig. 5 b), le nombre d’extrémités racinaires (Fig. 5 j) et le nombre de fourches racinaires (Fig. 5 l) ont été significativement diminués, tandis que le diamètre total moyen des racines (Fig. 5 f) a été significativement augmenté dans le compartiment B (BK-P/B) par rapport au compartiment A (BK-P/A). Le poids sec des racines était similaire dans les deux compartiments (Fig. 5 n). Même si la surface racinaire totale était plus faible dans BK-P/B par rapport à BK-P/A, la différence n’était pas significative (Fig. 5 d).
En comparant les paramètres racinaires des plantes P poussant seules avec celles poussant avec BK à racines fendues ; P voisin (NP), une diminution significative a été observée dans la longueur totale des racines (Fig. 6 a), la surface racinaire (Fig. 6 b), le volume racinaire (Fig. 6 d), le nombre d’extrémités racinaires (Fig. 6 e) et le nombre de fourches racinaires (Fig. 6 f) de NP. Alors qu’il n’y a pas eu de changement significatif dans le diamètre total moyen des racines et le poids sec des racines (Fig. 6 c, g).
Traitement des exsudats racinaires BK sur les semis P
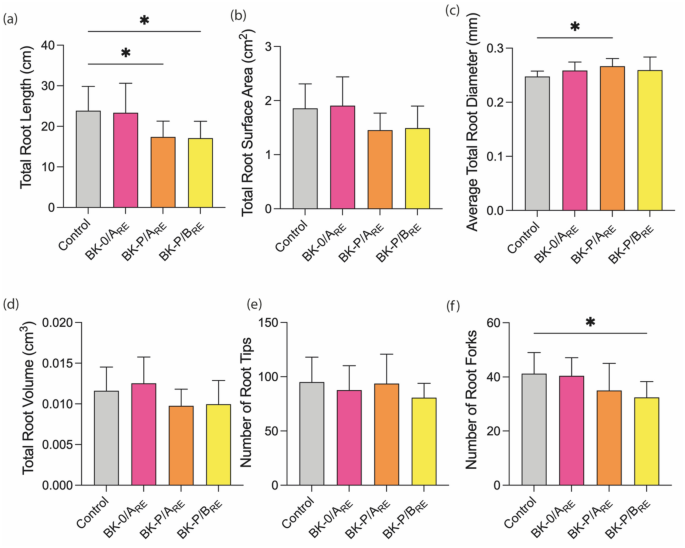
Les semis P ont été traités avec des exsudats racinaires pour évaluer l’impact des exsudats racinaires dérivés de BK interagissant avec les plantes voisines sur l’architecture du système racinaire P (Fig. 7 a, b, c, d, e, f). Les traitements aux exsudats racinaires BK-P (BK-P/A RE et BK-P/B RE ) ont significativement diminué la longueur totale des racines, tandis que le traitement BK-P/B RE a également significativement diminué le nombre de fourches racinaires (Fig. 7 a, f), cependant le traitement aux exsudats racinaires BK-0/A (BK-0/A RE ) n’a montré aucune différence dans la longueur totale des racines des semis P par rapport aux plantes témoins. Le diamètre racinaire moyen des P traités avec BK-P/A RE était significativement plus long que celui des plantes témoins (Fig. 7 c).
Discussion
L’étude des interactions entre les racines des plantes présente des défis en raison des difficultés techniques d’accès au système racinaire sans provoquer de perturbation. Alors que de nombreuses études utilisent des systèmes non intrusifs pour étudier les systèmes racinaires des plantes, nous avons établi un nouveau système racinaire divisé et une conception expérimentale qui, à notre connaissance, est la première à relever trois défis majeurs à la fois. Ce système (i) a permis la collecte d’exsudats racinaires sans perturber les systèmes racinaires, (ii) a permis le traitement différentiel de différentes parties d’un même système racinaire dans des compartiments séparés, (iii) et a permis l’observation et la caractérisation des changements dans les profils d’exsudats racinaires de plantes spécifiques interagissant avec différents voisins. Cela a permis d’étudier l’impact des différents facteurs de cette étude (c’est-à-dire la réponse de BK à différents voisins et la réponse de P aux applications d’exsudats provenant des différentes configurations voisines) qui ont apporté de nouvelles perspectives sur les modèles d’exsudats racinaires dans les interactions plante-plante.
Métabolomique de l’exsudat racinaire BK
Pour quantifier les changements métabolomiques dans les échantillons d’exsudats racinaires en réponse à la présence d’une plante voisine à l’aide d’un NTA, il est crucial de distinguer les différences entre les métabolites individuels dans diverses conditions testées. L’exsudation racinaire est un processus qui peut être passif ou actif et qui est influencé par plusieurs facteurs environnementaux et biologiques. Par conséquent, trouver un paramètre de normalisation biologique approprié présente des défis. Les métabolites qui sont produits de manière stable par la plante et relativement constants entre différents individus et au sein d’un individu au fil du temps 66 seraient des marqueurs optimaux pour la normalisation biologique. Cependant, ces types de marqueurs ne sont pas toujours présents et, en l’absence de tels marqueurs pour la métabolomique de l’exsudat racinaire, les paramètres de croissance des plantes sont principalement utilisés pour la normalisation. Dans notre expérience, nous avons observé une corrélation plus faible entre notre signal métabolique global et le poids sec des racines par rapport au nombre d’extrémités racinaires (Fig. 2 ). Cette divergence est logique étant donné que le schéma de distribution spatiale de l’exsudation racinaire n’est pas homogène le long de l’axe racinaire. L’exsudation des racines se produirait principalement au niveau des extrémités des racines 14 , entraînant des effets localisés dans de petites zones spatialement distinctes.
En utilisant la méthode de normalisation biologique développée, l’analyse du métabolisme des exsudats racinaires a visualisé les différences liées aux espèces, en séparant les échantillons d’exsudats racinaires P et BK (Fig. 3 b). Dans une étude précédente, les métabolomes des exsudats racinaires de différentes espèces de plantes — A. thaliana, B. distachyon et M. truncatula — différaient également les uns des autres 64 . Les auteurs ont émis l’hypothèse que les exsudats racinaires des plantes partagent un métabolome central et que la présence de métabolites spécifiques à l’espèce dans les exsudats pourrait réguler de manière distincte les interactions dans le sol. De même, les différences dans le métabolome des exsudats racinaires BK et P pourraient modifier différents paramètres tels que la dynamique des interactions culture-mauvaises herbes souterraines et la composition microbienne du sol 67 .
Dans cette étude, des différences d’exsudat sont observées non seulement entre les espèces mais aussi au sein des compartiments isolés de sarrasin ceux cultivés seuls (BK-0/A), ceux cultivés avec un autre voisin sarrasin (BK-BK/A) et ceux cultivés avec un voisin amarante à racine rouge (BK-P/A) (Fig. 3 c, 4 a–c), confirmant notre postulat selon lequel BK perçoit la présence de voisins intra- (BK) et interspécifiques (P) par le biais de systèmes racinaires en interaction et modifie systématiquement sa composition d’exsudat racinaire. D’autres études ont trouvé des réponses similaires. Dans une étude métabolomique recherchant les changements de métabolites chez cinq espèces de plantes de la même communauté poussant seules ou en association les unes avec les autres, les auteurs ont conclu que, bien que la diversité phylogénétique du voisinage n’ait pas eu d’effet important sur les changements observés, les plantes modulaient leur stratégie métabolique pour faire face aux différents niveaux de stress abiotique et biotique imposés par la présence de voisins 68 . Plus précisément, dans une co-culture de vesce velue de seigle, l’interaction interspécifique a affecté l’exsudation racinaire d’un composé flavonoïde et, selon le niveau de compétition, l’exsudation de ce flavonoïde a été augmentée ou diminuée 69 .
La particularité de notre approche était de pouvoir observer les changements systémiques dans l’exsudation racinaire. Les expressions différentielles observées sont probablement attribuées à une signalisation interne à longue distance au sein de la BK du compartiment B au compartiment A. Ce processus a été précédemment défini comme « l’exsudation racinaire de métabolites induite par le système » (SIREM) et a été décrit en réponse aux micro-organismes de la rhizosphère 67 , à l’assimilation de l’azote 70 et à la formation de nodules 69 . Les métabolites spécialisés sont principalement affectés par SIREM 70 . Dans d’autres études, ce signal a également été observé comme induisant des changements métaboliques dans les feuilles et les racines. Selon la littérature, plusieurs candidats ont été postulés comme molécules potentielles de signalisation interne à longue distance telles que les formes glycosylées de l’acide azélaïque et de l’acide pimélique et les peptides sécrétés 70 , 71 , 72 Cependant, de tels mécanismes n’ont pas encore été caractérisés dans la BK.
En examinant de plus près les composés spécifiques régulés à la hausse par les voisins intraspécifiques ou interspécifiques, il existe une réponse générale limitée à la présence de l’une ou l’autre des espèces voisines testées, comme le montre le diagramme de Venn de la Fig. 4d qui n’a qu’un chevauchement d’environ 7 % des métabolites régulés à la hausse. Il est évident que la plupart des changements dans les exsudats racinaires propres aux espèces testées en tant que voisins différents déclenchent des réponses distinctes. Des résultats similaires ont été rapportés précédemment dans une autre étude où l’accumulation et l’exsudation des polyphénols BK différaient selon que la plante voisine était Lolium rigidum Gaud. ou Portulaca oleracea L 73 . Nous postulons que la différence de réponse pourrait être due à deux raisons. Le sarrasin peut reconnaître d’autres voisins de sarrasin ou d’amarante à racine rouge (par exemple, grâce aux composés spécifiques à l’espèce mis en évidence) et répondre à leurs signaux uniques. Les héritages chimiques du sol spécifiques à l’espèce affectent également la composition et la dynamique de la végétation par le biais d’effets de rétroaction plante-sol 74 . Français Des études montrent que la rétroaction négative chez le blé entraîne la libération de métabolites secondaires de la famille des benzoxazinoïdes 75 . Cependant, des informations supplémentaires sont nécessaires pour suggérer que c’est ce qui se passe spécifiquement, et d’autres études seraient nécessaires pour évaluer la persistance des métabolites dans le substrat, la prochaine génération de plantes et les conséquences de cette rétroaction possible. En alternative ou en plus de cette reconnaissance chimique spécifique, les différents voisins peuvent induire différents types de stress (compétition des ressources, physique et/ou chimique) et la plante de sarrasin fendu peut réagir en conséquence. Une étude précédente appuie cette hypothèse en montrant que les exsudats racinaires étaient corrélés à des traits compétitifs (respiration racinaire, concentration en N) pour 18 espèces ligneuses 76 .
Modifications dans l’architecture racine BK
En analysant les effets des plantes voisines sur la dynamique du système racinaire, la diminution observée dans les compartiments où les voisins BK et P étaient présents sans contact racine-racine (Fig. 5 i) pourrait faire partie de la réponse aux signaux, car les extrémités des racines améliorent la capacité des plantes à répondre à la fois aux signaux internes et aux stimuli externes de l’environnement, à explorer la rhizosphère et à absorber l’eau et les nutriments 77 , 78 . Les extrémités des racines sont les premières parties de la plante à explorer un nouvel environnement, elles peuvent influencer la dynamique des interactions plante-plante. Une étude précédente a montré que les espèces de graminées envahissantes avec un nombre plus élevé d’extrémités de racines ont une plus grande chance de survie dans des conditions de terrain 79 .
Dans notre étude, la diminution du nombre d’extrémités racinaires en présence d’un voisin BK et P pourrait être due à plusieurs facteurs : BK pourrait avoir concurrencé des ressources essentielles et les exsudats racinaires jouent un rôle dans la mobilisation des nutriments du sol, ce qui à son tour influence l’architecture du système racinaire. Dans une étude précédente, la composition de l’exsudat racinaire a montré une variation entre différentes espèces et en fonction de la morphologie racinaire 80 . Les altérations de l’architecture du système racinaire affectent l’exsudation racinaire, l’attraction des micro-organismes, ainsi que la fonction, la décomposition et le devenir des exsudats racinaires 81 . Par conséquent, la composition microbienne de la rhizosphère pourrait être différente et/ou les exsudats racinaires libérés par les plantes voisines pourraient avoir eu un effet inhibiteur sur la croissance des racines de BK. Dans des études précédentes menées sur des semis de radis, l’exposition non pas à des exsudats racinaires mais à des extraits aqueux de Fallopia a gravement endommagé les extrémités des racines de radis et supprimé leur croissance 82 , 83 .
Dans notre configuration, bien que les semis P nécessitent moins d’eau, de nutriments et d’espace en raison de leur plus petite taille par rapport aux plantes BK, ils entraînent toujours une diminution significative du nombre d’extrémités de racines BK. De plus, les paramètres racinaires qui sont souvent associés à la compétition, tels que la longueur totale des racines (qui offrirait un avantage pour accéder aux ressources si elle était plus longue 84 ) et la surface racinaire totale (offrant une plus grande surface pour absorber l’eau et les nutriments 85 ) n’étaient pas significativement différents entre les compartiments avec et sans voisin. Cela suggère que la réduction des extrémités des racines pourrait ne pas s’expliquer uniquement par la compétition pour les ressources et que la composition des exsudats racinaires libérés par la plante voisine pourrait jouer un rôle.
Le fait que la longueur totale des racines, le diamètre moyen des racines, le nombre d’extrémités racinaires et le nombre de fourches racinaires étaient plus faibles dans le compartiment avec contact racine-racine direct que dans le compartiment sans (Fig. 5 ) indique que BK préférait allouer ses racines dans un compartiment qui n’était pas déjà occupé par une autre plante, et déplaçait l’allocation de ses racines en réponse à l’épuisement des ressources ou simplement à la présence de plantes voisines. Les racines de BK dans le compartiment où il y a un contact racine-racine direct détectent les racines des plantes voisines, la disponibilité de l’eau et des nutriments, générant ensuite des réponses locales en déclenchant des voies de signalisation spécifiques. En conclusion, non seulement le profil d’exsudat racinaire a changé lors du SIREM, mais l’architecture du système racinaire de BK a également été altérée.
Modifications de l’architecture racinaire de P interagissant directement avec BK et en réponse aux traitements par exsudats racinaires BK
La présence de BK dans les systèmes à racines divisées a eu un impact négatif sur la croissance des racines du P voisin comme le montre précédemment la Fig. 6. Comme discuté précédemment pour BK, les changements dans les paramètres des racines du P voisin, en comparaison des paramètres des racines du P cultivé seul, peuvent être attribués à de multiples facteurs tels que la compétition des ressources entre les plantes BK et P, les contraintes spatiales, les composés chimiques libérés par les racines du BK et les effets de l’ombre. Les changements dans la croissance, le placement et l’architecture des racines du P par la présence d’une plante voisine sont décrits de manière éparse dans la littérature. Dans notre étude précédente, BK a supprimé la croissance du P sans interactions physiques avec les racines 56 . Dans une autre étude, la présence de maïs a significativement réduit la densité racinaire du P dans les couches superficielles du sol alors que les racines s’étendaient dans un sol plus profond en présence du maïs voisin 86 . Dans une autre étude, bien que la densité racinaire ait été affectée, il a été démontré que le blé n’affectait pas la réponse au placement des racines du P. Cependant, lorsque le 6-méthoxy-benzoxazolin-2-one, un allélochimique du blé, a été appliqué, il y a eu une réponse 87 .
Étant donné que les interactions entre plantes impliquent une interaction complexe entre la compétition, les interactions chimiques et les réponses adaptatives qui permettent aux plantes de survivre et de prospérer, il était pertinent de contrôler autant de facteurs environnementaux que possible qui ont un impact sur la vigueur des plantes au cours des expériences. Plus précisément, lors de l’application d’exsudats racinaires, il était essentiel d’éliminer les effets des variations de nutriments entre les différentes conditions de croissance. De plus, la plupart des tests biologiques impliquent des essais en boîte de Petri où les exsudats racinaires ne sont appliqués qu’une seule fois sur de très jeunes plants. Lorsque les plantes sont cultivées ensemble dans des systèmes à racines divisées ou dans des conditions de terrain, elles sont exposées à des composés libérés en continu par les racines de chaque plante voisine ; cette exposition continue peut induire des réponses dans chaque plante voisine. Pour imiter ce processus d’exsudation sans qu’une plante voisine soit présente pour avoir un impact sur l’espace physique, des exsudats racinaires BK ont été appliqués quotidiennement en petites quantités (environ 7,5 % du volume total extrait de la moitié d’un système racinaire).
La longueur des racines, un paramètre associé à la performance globale d’une plante et à sa capacité à occuper l’espace souterrain 88 , a été réduite chez P lorsqu’elle a été traitée avec des exsudats racinaires de BK interagissant avec les voisins P, à la fois sans contact racine-racine direct et avec contact racinaire direct (Fig. 7 a). Cela concorde avec nos expériences précédentes 89 où des composés dérivés des racines de BK cultivés à proximité immédiate de P ont été appliqués à des semis de P, ce qui a conduit à une diminution de l’élongation primaire des racines par rapport aux composés dérivés des racines obtenus à partir de monocultures de BK.
Ces résultats suggèrent que des changements dans la composition chimique des exsudats racinaires BK induits par un voisin P ont conduit à la réduction de la longueur totale des racines des plantules P. Les exsudats racinaires BK obtenus à partir de systèmes racinaires divisés interagissant avec P, qu’ils aient un contact racinaire direct, entraînant des réponses locales ou qu’ils n’aient pas de contact racinaire direct, entraînant des réponses systémiques, ont provoqué une diminution significative de la longueur totale des racines de P. D’autre part, le traitement des exsudats racinaires obtenus à partir du compartiment où les racines BK et P sont en contact direct a significativement diminué le nombre de fourches racinaires de P (Fig. 7 f). Nous supposons que parmi les 46 métabolites régulés à la hausse dans BK en présence de P, un ou plusieurs d’entre eux sont impliqués dans la réduction de la longueur totale des racines observée par l’interaction interspécifique BK-P.
De plus, nous avons observé une réduction plus importante de la longueur totale des racines du voisin P dans les systèmes à racines divisées que dans les traitements aux exsudats racinaires. De plus, divers autres paramètres racinaires du P étaient significativement différents dans les systèmes à racines divisées en présence de BK (Fig. 6 ). Comme prévu, l’interaction directe entre les plantes BK et P cultivées ensemble entraîne davantage de changements dans les paramètres racinaires du P. Cela pourrait être dû à la compétition entre BK et P ainsi qu’à une période d’interaction plus longue (14 jours de croissance dans les systèmes à racines divisées par rapport à 10 jours d’application d’exsudats racinaires). Cela pourrait également être associé à une meilleure répartition/diffusion/concentration plus élevée des exsudats racinaires lorsque les plantes sont cultivées ensemble que lors de l’application d’exsudats racinaires.
Conclusion
Cette étude démontre que le profil métabolique de l’exsudat racinaire de BK change en réponse aux plantes voisines et que le système racinaire et la morphologie de BK et de son voisin P sont affectés par leur interaction. De plus, les changements dans l’exsudation racinaire sont principalement propres aux espèces voisines testées. De plus, même lorsque BK et P ne partagent pas le même espace, les exsudats racinaires obtenus à partir de la co-culture ont toujours un impact sur le système racinaire P. En montrant un lien direct entre la présence physique, l’exsudation chimique et la réponse morphologique, ces résultats mettent en évidence la nature dynamique des exsudats racinaires et les implications de ces signaux sur les plantes poussant à proximité dans le cadre des communications plante-plante. Dans des études futures, obtenir des informations plus approfondies en ciblant les composés d’intérêt exprimés de manière différentielle détectés dans cette étude pour élucider leur structure chimique et leur génétique pourrait ouvrir la voie au développement de nouvelles stratégies de lutte contre les mauvaises herbes. Une fois identifiés, ces composés pourraient être purifiés et testés pour leurs effets sur différentes espèces de mauvaises herbes. Cela permettrait d’améliorer les variétés ou les pratiques agricoles pour augmenter la concentration et la persistance des composés suppresseurs de mauvaises herbes dans les exsudats des cultures de couverture afin de maximiser l’effet de ces exsudats sur la communauté des mauvaises herbes.
Matériel et méthodes
Matériel végétal et conditions de croissance
Des boîtes de Petri carrées de 120 × 15 mm (Corning) ont été recouvertes de deux feuilles de papier filtre Whatman autoclavé et humidifiées avec une solution de Hoagland à demi-concentration (Hoagland’s No. 2 Basal Salt Mixture, Sigma-Aldrich) avec un pH de 5,8. Une rangée de cinq graines de BK (variété : Lileja) a été placée dans chaque boîte de Petri et recouverte de papier filtre de demi-taille. Elles ont été scellées à l’aide d’un parafilm et placées sur un support à un angle de 90° dans un phytotron (Aralab, Clitec) réglé à 24 °C pendant 16 h et à 18 °C pendant 8 h avec une humidité relative de 70 % et conservées dans l’obscurité pendant 3 jours.
Les racines BK émergentes ont été soigneusement coupées quelques millimètres au-dessus de l’apex racinaire à l’aide d’un scalpel stérilisé (Fig. 1 a) pour induire le développement de racines secondaires 90 facilitant la division ultérieure du système racinaire (Fig. 1 c). La coupe des racines est une procédure induisant du stress qui nécessite un processus de récupération. La coupe partielle des racines avec 2 semaines de récupération a été choisie car elle induit moins de stress que l’éradication 91 . Les boîtes de Petri ont été à nouveau scellées avec du parafilm et transférées dans le phytotron réglé sur une photopériode de 16:8 h de lumière/obscurité, 24/18 °C et une humidité relative de 70 % pendant 5 jours. Les semis BK âgés de 7 jours ont été transférés dans des systèmes à racines divisées (Fig. 1 b).
Préparation du système racinaire divisé
Toutes les plantes ont été cultivées dans un récipient d’extraction en phase solide (SPE) de 60 ml (Bond Elut 12131018, Agilent Technologies) rempli de billes de verre de 250 à 400 µm (Guyson SA). L’extérieur des cartouches a été recouvert d’un film autocollant noir (Fig. 1 e). Pour les systèmes à racines divisées, deux cartouches SPE ont été modifiées en faisant fondre un petit demi-cercle à leur sommet pour stabiliser les plantules, puis elles ont été fixées ensemble. Pour les conditions sans racines divisées, une seule cartouche SPE a été remplie de billes de verre. Les plantules BK ont été soigneusement transférées des boîtes de Petri. Les racines ont été comptées pour chaque plantule et divisées en deux parties égales ; les plantules avec un nombre impair de racines ont été équilibrées en plaçant la racine la plus longue dans le compartiment avec le moins de racines (Fig. 1 c). Les racines divisées ont été placées dans les cartouches SPE pour créer deux compartiments, qui seront appelés compartiments A et B à partir de maintenant. Après avoir divisé les racines BK, les graines des plantes voisines ont été placées uniquement dans le compartiment B. Les voisines étaient soit des graines BK pour les interactions homospécifiques, soit des graines P pour les interactions hétérospécifiques. Les graines P ont été récoltées dans un champ d’Agroscope, Changins, Suisse et l’utilisation de plantes P dans la présente étude est conforme aux directives internationales, nationales et institutionnelles et l’étude a été menée conformément à la législation en vigueur. Cela a établi trois conditions de système à racines divisées, chacune avec deux compartiments, ainsi que deux conditions sans racines divisées et des témoins à blanc (Fig. 1 d). Chaque cartouche remplie de billes de verre a été humidifiée avec une solution de Hoagland à demi-concentration. Initialement, deux graines BK et dix graines P ont été semées dans leurs compartiments B respectifs. Après la germination, les semis BK ont été éclaircis à une et les semis P à trois. Les plantes ont été cultivées dans un phytotron avec une photopériode de 16:8 h de lumière/obscurité à 24/18 °C et 70 % d’humidité relative pendant 2 semaines. Chaque compartiment a été irrigué quotidiennement avec 5 ml de solution de Hoagland à demi-concentration, y compris les blancs sans plantes. L’extraction de l’exsudat racinaire a été effectuée le 14e jour (n = 3–5).
Installation du collecteur et extraction de l’exsudat racinaire
Les exsudats racinaires ont été collectés à partir de plantes à racines fendues et non fendues cultivées dans des cartouches SPE. Les exsudats ont été extraits à l’aide d’un collecteur à vide SPE (Macherey-Nagel) connecté à une pompe à vide (V-300, Buchi) contrôlée par une interface Buchi I-300 Pro. Des tubes à centrifuger coniques de 50 ml (Corning) ont été placés sous des aiguilles en acier inoxydable (Macherey-Nagel). L’interface avec la pompe a été réglée à 780 mbar, maintenant la pression de la chambre en verre à 5 mmHg. Les exsudats racinaires ont été collectés dans (i) le compartiment A sans contact racinaire direct : BK à racines divisées sans voisin (BK-0/A), BK à racines divisées avec BK voisin (BK-BK/A) et BK à racines divisées avec P voisin (BK-P/A), (ii) le compartiment B avec contact racinaire direct : BK à racines divisées avec P voisin (BK-P/B), et iii) BK et P sans racines divisées, et témoins vierges (Fig. 1 d et e).
Collecte d’exsudats racinaires pour analyse par spectrométrie de masse
Les cartouches SPE ont été placées sur les robinets d’arrêt du collecteur. La pompe à vide a été démarrée et 30 ml de solvant d’extraction ont été ajoutés à chaque cartouche sur une période de 30 s. Le solvant d’extraction était composé de 95 % (p/v) de méthanol (Merck Uvasol), de 4,95 % (p/v) d’eau nano pure et de 0,05 % (p/v) d’acide formique (VWR, HiPerSolv Chromanorm pour LC–MS) avec un étalon interne d’acide 3,5-di-tert-butyl-4-hydroxybenzoïque (Sigma-Aldrich) ajouté à une concentration finale de 0,5 µmol·L -1 . Les robinets d’arrêt ont été laissés ouverts pendant 30 s supplémentaires, ce qui a permis d’aspirer les exsudats racinaires pendant un total de 1 min par échantillon afin de minimiser l’exposition des racines au solvant d’extraction. À partir de chaque échantillon, 10 ml ont été transférés dans des tubes à essai Pyrex de 16 × 160 mm (SciLabware) et évaporés à l’aide d’un concentrateur d’échantillons sous vide (Genevac EZ-2 Plus) réglé à 35 °C. Le concentrateur a été initialement réglé sur « mode HPLC » pendant une heure, suivi d’un « mode aqueux » pendant 2 heures ou plus si un séchage supplémentaire était nécessaire pour atteindre un volume final approximatif de 200 µl afin de garantir que les échantillons ne soient pas complètement séchés.
Collecte d’exsudats racinaires pour application sur P
Les exsudats racinaires ont été collectés à partir de systèmes à racines divisées en utilisant la configuration du collecteur mentionnée précédemment. Cependant, cette fois, de l’eau nano pure a été utilisée comme solvant d’extraction. 30 ml d’eau nano pure ont été ajoutés pendant 30 s à chaque cartouche et aspirés pendant une minute pour éliminer la solution de Hoagland. Ensuite, 15 ml d’eau nano pure ont été ajoutés à chaque cartouche et les plantes ont été replacées dans le phytotron pendant 24 h pour permettre la régénération et la libération des exsudats racinaires. Les exsudats racinaires ont ensuite été à nouveau extraits avec 30 ml d’eau nano pure. Cela a donné lieu à un deuxième ensemble d’exsudats racinaires dont les concentrations en sel de Hoagland ne variaient pas dans différentes conditions expérimentales. La consistance de la matrice des extraits a été confirmée en mesurant la conductivité électrique et le pH. Les seconds extraits obtenus après l’incubation de 24 h ont été regroupés pour obtenir un mélange homogène. Dix graines de P ont été semées dans des cartouches SPE individuelles. Trois millilitres de solution de Hoagland à demi-concentration ont été ajoutés à chaque tube chaque jour pendant les 5 premiers jours. Les plants P ont été éclaircis à quatre plantes le cinquième jour. Au cours des 10 jours suivants, les plants P ont reçu 3 ml d’exsudats racinaires BK-0, BK-P/A ou BK-P/B, et les témoins ont reçu 3 ml d’eau nano pure chaque jour. Ils ont également reçu 1 ml de solution de Hoagland à demi-concentration tous les deux jours pour s’assurer qu’ils avaient suffisamment de nutriments (n = 10). À la fin du traitement, une analyse de la morphologie des racines a été réalisée sur les plants P.
Préparation, numérisation et analyse d’échantillons de racines
Les plantes ont été délicatement retirées de leurs cartouches et soigneusement lavées pour éliminer les billes de verre après la collecte des exsudats racinaires et l’application de ces derniers. Les échantillons de racines ont été transférés dans un plateau transparent (Reagent Instruments Inc.) et immergés dans l’eau. Ils ont été soigneusement étalés pour minimiser le chevauchement et scannés à l’aide d’un scanner (Epson Perfection V700 Photo). Paramètres racinaires : longueur totale des racines (mm), surface racinaire (mm2 ) , diamètre total moyen des racines (mm), volume racinaire (mm3 ) et nombre d’extrémités et de fourches racinaires ont été analysés à l’aide de WinRHIZO Basic 2021 (Regent Instruments Inc.). De plus, le poids sec des racines et des racines au-dessus du sol (mg) a été mesuré en les plaçant dans une étuve à 50 °C pendant 48 h, puis en les pesant. La signification statistique (p < 0,05) des paramètres racinaires a été évaluée soit par un test t de Student, soit par une ANOVA à un facteur suivie d’un test de comparaisons multiples post hoc de Dunnett considérant BK-0/A comme contrôle et comparant chaque moyenne à ce contrôle en utilisant GraphPad Prism (version 9.2.0 pour MacOS, GraphPad Software).
Préparation d’échantillons et analyse spectrométrique de masse non ciblée
Des extraits d’échantillons concentrés (~ 200 µl) ont été transférés dans des flacons en verre ambré HPLC de 1,5 ml (Altmann Analytik) et reconstitués à une concentration 30 fois supérieure au volume d’origine dans 89,9 % d’H2O ultrapure (MilliQ avec accessoire LC-Pak, Merck), 10 % de méthanol (CHROMASOLV, Honeywell) et 0,1 % d’acide formique (% v/v, Fluka, Honeywell). Les particules ont été éliminées à l’aide d’un filtre centrifuge Amicon 30 kDa Ultra-0,5 (Merck). Les échantillons de contrôle qualité (CQ) comprenaient un échantillon groupé. Les échantillons, y compris les CQ, ont été séparés en deux aliquotes de 100 µl pour les modes d’ionisation négative et positive et stockés à -80 °C jusqu’à la mesure, puis stockés à 4 °C dans l’échantillonneur automatique (1290 Infinity II, Agilent Technologies) pendant la séquence de mesure. Le système de chromatographie liquide à temps de vol quadripolaire (LC-QTOF-MS) était contrôlé par le logiciel d’acquisition MassHunter (version 10.1, Agilent Technologies). Les échantillons ont été injectés dans un ordre aléatoire. Les contrôles de qualité ont été mesurés tous les 13 ou 14 échantillons pour surveiller les performances du système LC-QTOF-MS et normaliser les données. Un système UHPLC avec pompe binaire (1290 Infinity II, Agilent Technologies) a été utilisé pour effectuer une séparation chromatographique sur une colonne de pentafluorophényle Discovery HS F5 (150 × 2,1 mm, taille de particule de 3 μm, Sigma-Aldrich) associée à une cartouche Discovery HS F5 Supelguard (Sigma-Aldrich). La phase mobile A était de l’eau ultra pure avec 0,1 % d’acide formique (% v/v, Fluka, Honeywell) et la phase mobile B était du méthanol (CHROMASOLV, Honeywell) avec 0,1 % d’acide formique (% v/v). Français Le gradient est indiqué dans le tableau S3 a. Le volume d’injection était de 5 μL. Le temps d’analyse total était de 15,5 min par injection, avec un débit constant de 350 μL min −1 et une température de four à colonne de 50 °C (1290 Infinity II). La solution de masse de référence (HP-0921, Purine, TFANH 4 , Agilent Technologies) a été pompée (1260 Infinity, Agilent Technologies) en tandem via un pulvérisateur secondaire vers l’interface d’ionisation par électrospray pour l’étalonnage de masse en ligne (m/z = 121,0509 et 922,0098 (+) ; m/z = 119,0363 et 966,0007 (−)).
Les données ont été collectées avec un LC-QTOF-MS (6560, Agilent Technologies, Santa Clara, CA, USA) avec une source Dual AJS ESI. Les données ont été acquises en mode d’acquisition dépendante des données (DDA) avec un rapport masse/charge (m/z) compris entre 50 et 1700 et cinq précurseurs max par cycle et stockées en mode profil. Les paramètres de la source et des informations plus détaillées sur l’acquisition des données sont disponibles dans le tableau S3 b.
Un mélange d’exsudats racinaires factices a été constitué de 58 étalons chimiques de composés connus dans la littérature comme étant exsudés par les racines des plantes (tableau S4 ). Il a été utilisé pour vérifier la répétabilité de l’intensité du signal et des temps de rétention de l’instrument.
Évaluation des données LC–MS/MS non ciblées
Après l’acquisition des données, celles-ci ont été retraitées avec le logiciel de retraitement Agilent (MassHunter Workstation version 10.0, Agilent Technologies) en centrisant les données et en les recalibrant par rapport à la solution de référence.
Le prétraitement a été effectué à l’aide de MS DIAL (version 4.9 92 ). Seuls les pics qui ont élué au-delà du seuil inférieur du temps de rétention de 1,8 min avec une hauteur minimale de 1E3 et une largeur de pic minimale de 6 points de données ont été sélectionnés. Les isotopologues ont été agrégés et les adduits ont été annotés. Une base de données interne a été appliquée pour la confirmation de l’identité qui correspondait aux caractéristiques en fonction de leur temps de rétention, de leur m/z et de leur modèle de fragmentation MS2. Cette base de données a été générée à l’aide des données du mélange d’exsudats racinaires factices susmentionné dans MS FINDER, version 3.6. Ces métabolites ont été identifiés à un niveau 1 selon Schymanski et al. 65 . Les pics sélectionnés ont ensuite été alignés sur les échantillons avec une tolérance MS1 de 15 mDa et une tolérance de temps de rétention de 0,2 min. Après l’alignement, le remplissage des espaces vides des valeurs manquantes a été effectué. Une filtration supplémentaire à blanc (moyenne de l’échantillon quintuple/moyenne à blanc) et un minimum de 60 % de présence de groupe ont été appliqués. Les données de tous les composés ont été normalisées par rapport à la norme interne et aux échantillons de contrôle qualité groupés à l’aide d’une régression de lissage de nuage de points pondéré localement (LOWESS). Des paramètres de prétraitement MS DIAL plus détaillés sont disponibles dans le tableau S5 .
D’autres manipulations de données et analyses statistiques ont été réalisées dans RStudio (version 2023.06.0+421). Un seuil moyen de signal sur bruit (S/N) de 10 a été appliqué. Les adduits qui n’avaient pas de valeur protonée ou déprotonée correspondante ont été ré-annotés comme des caractéristiques M+H ou M−H. Les adduits ont été mis en correspondance avec leurs homologues protonés ou déprotonés et les valeurs de surface de pic ont été additionnées pour générer une valeur de signal composé total (TCS). Pour trouver un paramètre approprié pour la normalisation biologique, les valeurs TCS ont été corrélées soit au nombre d’extrémités de racines, soit au poids des racines en grammes, puis normalisées en divisant le TCS par le nombre d’extrémités de racines. Pour BK-P/B (voir Fig. 1 d), il y avait des composés exsudant des racines BK et P. Le mélange de métabolites exsudés n’a pas permis de normaliser biologiquement en une seule espèce pour la plupart des métabolites. Cependant, si un composé était spécifique à une seule espèce, la valeur était normalisée biologiquement en fonction de l’espèce à laquelle ce métabolite était unique dans le compartiment BK-P/B. Étant donné que les échantillons de contrôle qualité ont été générés à partir d’un échantillon groupé, ils ont été normalisés en fonction du nombre moyen d’extrémités de racines par compartiment.
Pour chaque échantillon, les valeurs individuelles du TCS ont été additionnées pour réduire les données en une seule variable cumulative. De plus, chaque échantillon comportait encore des centaines de variables individuelles du TCS pour chaque composé. Les valeurs cumulatives du TCS et chaque signal individuel du TCS ont fait l’objet d’une évaluation statistique univariée. Les moyennes, les distributions et la variation ont été calculées et visualisées par la création de diagrammes en boîte et à moustaches. Les valeurs aberrantes ont été définies et calculées comme tout ce qui est supérieur à 1,5 * écart interquartile (IQR) au-dessus du troisième quartile ou en dessous du premier quartile. La variation entre les groupes a été évaluée par le test F lorsque deux groupes ont été comparés ou par le test de Bartlett pour plusieurs groupes. Le test de signification a été effectué à l’aide d’un test t lors de la comparaison de deux groupes ou d’une ANOVA lors de la comparaison de plusieurs groupes. Lors de la comparaison de groupes avec une variance inégale, le test t et l’ANOVA ont été modifiés en variantes de Welch. Selon les comparaisons effectuées, un test post-hoc T3 de Dunnett modifié pour permettre un groupe témoin (calculé à l’aide de GraphPad Prism version 9.2.0) ou un test post-hoc Games-Howell ont été calculés. Les métabolites importants d’intérêt ont été visualisés grâce à la création de tracés volcaniques qui ont utilisé le test t de Welch susmentionné en plus des calculs de changement de repli.
Une réduction dimensionnelle multivariée a été réalisée en utilisant chaque TCS individuel comme variable d’entrée et visualisée par analyse en composantes principales (ACP) et analyse discriminante des moindres carrés partiels (PLS-DA). Toutes les données ont été centrées et mises à l’échelle automatiquement avant l’analyse multivariée.
Disponibilité des données
Les ensembles de données utilisés et/ou analysés au cours de l’étude actuelle sont disponibles auprès de l’auteur correspondant sur demande raisonnable.
Références
- Wang, N.-Q., Kong, C.-H., Wang, P. & Meiners, SJ Signaux d’exsudats racinaires dans les interactions plante-plante. Plant Cell Environ. 44 , 1044–1058. https://doi.org/10.1111/pce.13892 (2021).Article CAS PubMed Google Scholar
- Mommer, L., Kirkegaard, J. & van Ruijven, J. Interactions racine-racine : vers un cadre rhizosphère. Tendances Plant Sci. 21 , 209-217. https://doi.org/10.1016/j.tplants.2016.01.009 (2016).Article CAS PubMed Google Scholar
- Kegge, W. & Pierik, R. Composés organiques volatils biogéniques et compétition végétale. Trends Plant Sci. 15 , 126–132. https://doi.org/10.1016/j.tplants.2009.11.007 (2010).Article CAS PubMed Google Scholar
- Osipitan, OA, Dille, JA, Assefa, Y. & Knezevic, SZ Culture de couverture pour la suppression des mauvaises herbes en début de saison dans les cultures : revue systématique et méta-analyse. Agron. J. 110 , 2211–2221 (2018).Article Google Scholar
- Teasdale, J. et al. Cultures de couverture et gestion des mauvaises herbes. Gestion non chimique des mauvaises herbes : principes, concepts et technologie , 49–64 (2007).
- Rouge, A. et al. Suppression des mauvaises herbes dans les mélanges de cultures de couverture sous des niveaux contrastés de disponibilité des ressources. Eur. J. Agron. 136 , 126499. https://doi.org/10.1016/j.eja.2022.126499 (2022).Article Google Scholar
- Depuydt, S. Arguments pour et contre la reconnaissance des racines du soi et du non-soi chez les plantes. Front. Plant Sci. 5 , 614 (2014).Article PubMed PubMed Central Google Scholar
- Biedrzycki, ML & Bais, HP Reconnaissance de parenté chez les plantes : un comportement mystérieux non résolu. J. Exp. Bot. 61 , 4123–4128. https://doi.org/10.1093/jxb/erq250 (2010).Article CAS PubMed Google Scholar
- Becker, C. et al. La génétique écologiquement pertinente des interactions entre plantes. Trends Plant Sci. 28 , 31–42. https://doi.org/10.1016/j.tplants.2022.08.014 (2023).Article CAS PubMed Google Scholar
- Martorell, C. & Freckleton, RP Test des rôles de la compétition, de la facilitation et de la stochasticité sur la structure de la communauté dans un assemblage riche en espèces. J. Ecol. 102 , 74–85. https://doi.org/10.1111/1365-2745.12173 (2014).Article Google Scholar
- Zhang, X., Yan, J., Khashi u Rahman, M. & Wu, F. L’impact des exsudats racinaires, des composés organiques volatils et des réseaux mycorhiziens courants sur l’architecture du système racinaire dans les interactions racine-racine. J. Plant Interact. 17 , 685–694 (2022).Article CAS Google Scholar
- Caffaro, MM, Vivanco, JM, Botto, J. & Rubio, G. L’architecture racinaire d’Arabidopsis est affectée par la compétition avec les plantes voisines. Plant Growth Regul. 70 , 141–147. https://doi.org/10.1007/s10725-013-9786-7 (2013).Article CAS Google Scholar
- Subrahmaniam, HJ et al. La génétique sous-jacente à la variation naturelle des interactions entre plantes, un membre apprécié mais oublié de la famille des interactions biotiques. Plant J. 93 , 747–770. https://doi.org/10.1111/tpj.13799 (2018).Article CAS PubMed Google Scholar
- Canarini, A., Kaiser, C., Merchant, A., Richter, A. & Wanek, W. Exsudation racinaire des métabolites primaires : mécanismes et leurs rôles dans les réponses des plantes aux stimuli environnementaux. Front. Plant Sci. 10 , 157. https://doi.org/10.3389/fpls.2019.00157 (2019).Article PubMed PubMed Central Google Scholar
- Schandry, N. & Becker, C. Plantes allélopathiques : modèles pour l’étude des interactions entre plantes et règnes. Trends Plant Sci. 25 , 176–185. https://doi.org/10.1016/j.tplants.2019.11.004 (2020).Article CAS PubMed Google Scholar
- Semchenko, M., Saar, S. & Lepik, A. Les exsudats des racines des plantes favorisent la reconnaissance des voisins et déclenchent des changements comportementaux complexes. New Phytol. 204 , 631–637. https://doi.org/10.1111/nph.12930 (2014).Article PubMed Google Scholar
- Badri, DV et Vivanco, JM Régulation et fonction des exsudats racinaires. Plant Cell Environ. 32 , 666–681 (2009).Article CAS PubMed Google Scholar
- Bais, HP, Broeckling, CD et Vivanco, JM Métabolites secondaires dans l’écologie du sol 241–252 (Springer, 2008).Livre Google Scholar
- Casas, ME & Matamoros, V. Défis analytiques et solutions pour réaliser une analyse métabolomique des exsudats racinaires. Tendances Environ. Anal. Chem. 31 , e00130 (2021).Article Google Scholar
- Ma, W. et al. Les exsudats racinaires contribuent aux points chauds des écosystèmes souterrains : une revue. Front. Microbiol. 13 , 937940. https://doi.org/10.3389/fmicb.2022.937940 (2022).Article PubMed PubMed Central Google Scholar
- Dietz, S. et al. Composition de l’exsudat racinaire des espèces de graminées et de plantes herbacées dans les prairies naturelles. Sci. Rep. 10 , 10691. https://doi.org/10.1038/s41598-019-54309-5 (2020).Article PUBLICITÉS CAS PubMed PubMed Central Google Scholar
- Gargallo-Garriga, A. et al. Les métabolomes des exsudats racinaires changent sous l’effet de la sécheresse et montrent une capacité de récupération limitée. Sci. Rep. 8 , 12696. https://doi.org/10.1038/s41598-018-30150-0 (2018).Article PUBLICITÉS CAS PubMed PubMed Central Google Scholar
- Chai, YN et Schachtman, DP Les exsudats racinaires ont un impact sur les performances des plantes soumises à un stress abiotique. Trends Plant Sci. 27 , 80–91 (2022).Article CAS PubMed Google Scholar
- Sasse, J., Martinoia, E. & Northen, T. Nourrissez vos amis : les exsudats des plantes façonnent-ils le microbiome racinaire ?. Trends Plant Sci. 23 , 25–41 (2018).Article CAS PubMed Google Scholar
- Hazrati, H., Fomsgaard, IS & Kudsk, P. Benzoxazinoïdes exsudés par les racines : absorption et translocation dans les plantes voisines. J. Agric. Food Chem. 68 , 10609–10617 (2020).Article CAS PubMed Google Scholar
- Macías, FA et al. Études de dégradation des benzoxazinoïdes. Dynamique de dégradation du sol de la 2, 4-dihydroxy-7-méthoxy-(2H)-1, 4-benzoxazine-3 (4H)-one (DIMBOA) et de ses produits de dégradation, composés phytotoxiques allélochimiques des graminées. J. Agric. Food Chem. 52 , 6402–6413 (2004).Article PubMed Google Scholar
- Eroğlu, Ç. G., Gfeller, A., Louw-Gaume, AE & Wirth, J. Progrès dans la compréhension des interactions allélopathiques entre les mauvaises herbes et les cultures. (2022).
- Serra Serra, N., Shanmuganathan, R. & Becker, C. Allélopathie chez le riz : une histoire de momilactones, de reconnaissance de parenté et de gestion des mauvaises herbes. J. Exp. Bot. 72 , 4022–4037 (2021).Article PubMed Google Scholar
- Kato-Noguchi, H. & Peters, RJ Le rôle des momilactones dans l’allélopathie du riz. J. Chem. Ecol. 39 , 175–185 (2013).Article CAS PubMed Google Scholar
- Schulz, M., Marocco, A., Tabaglio, V., Macias, FA & Molinillo, JMG Benzoxazinoïdes dans l’allélopathie du seigle : de la découverte à l’application dans la lutte durable contre les mauvaises herbes et l’agriculture biologique. J. Chem. Ecol. 39 , 154–174. https://doi.org/10.1007/s10886-013-0235-x (2013).Article CAS PubMed Google Scholar
- Hussain, MI et al. Benzoxazinoïdes dans l’allélopathie du blé : de la découverte à l’application pour une gestion durable des mauvaises herbes. Environ. Exp. Bot. 202 , 104997. https://doi.org/10.1016/j.envexpbot.2022.104997 (2022).Article CAS Google Scholar
- Kato-Noguchi, H., Sakata, Y., Takenokuchi, K., Kosemura, S. & Yamamura, S. Allélopathie chez le maïs I. : Isolement et identification de composés allélochimiques dans les plantules de maïs. Plant Prod. Sci. 3 , 43–46. https://doi.org/10.1626/pps.3.43 (2000).Article Google Scholar
- Lebecque, S. et al. Interaction entre les composés allélochimiques de l’orge, la gramine et l’hordénine, et les bicouches lipidiques artificielles imitant la membrane plasmique végétale. Sci. Rep. 8 , 9784. https://doi.org/10.1038/s41598-018-28040-6 (2018).Article PUBLICITÉS CAS PubMed PubMed Central Google Scholar
- Dayan, FE Facteurs modulant les niveaux de sorgoléone allélochimique dans Sorghum bicolor. Planta 224 , 339–346. https://doi.org/10.1007/s00425-005-0217-5 (2006).Article CAS PubMed Google Scholar
- Agapit, C., Gigon, A., Girin, T., Leitao, L. & Blouin, M. Optimisation du système racinaire divisé basée sur la survie, la croissance et le développement du modèle Poaceae Brachypodium distachyon. Physiol. Plantarum 168 , 227–236. https://doi.org/10.1111/ppl.12971 (2020).Article CAS Google Scholar
- Giertych, MJ et Leski, T. Le système racinaire divisé comme outil utile pour étudier la biologie des plantes ligneuses. Plant Soil 489 , 89–105. https://doi.org/10.1007/s11104-023-06025-3 (2023).Article CAS Google Scholar
- Shen, J., Li, H., Neumann, G. et Zhang, F. L’absorption des nutriments, la formation des racines en grappes et l’exsudation de protons et de citrate chez Lupinus albus sont affectées par l’apport localisé de phosphore dans un système à racines divisées. Plant Sci. 168 , 837–845. https://doi.org/10.1016/j.plantsci.2004.10.017 (2005).Article CAS Google Scholar
- Guo, S., Shen, Q. & Brueck, H. Effets de l’apport local d’azote sur l’absorption d’eau des plants de haricots dans un système racinaire divisé. J. Integr. Plant Biol. 49 , 472–480. https://doi.org/10.1111/j.1744-7909.2007.00436.x (2007).Article CAS Google Scholar
- Ferreira Torres, L., López de Andrade, SA & Mazzafera, P. Le split-root, le greffage et l’annelage comme outils expérimentaux pour étudier la signalisation racine-pousse-racine. Environ. Exp. Bot. 191 , 104631. https://doi.org/10.1016/j.envexpbot.2021.104631 (2021).Article CAS Google Scholar
- Irar, S., González, EM, Arrese-Igor, C. & Marino, D. Une approche protéomique révèle de nouveaux acteurs de la réponse des nodules à la sécheresse dans les plants de pois cultivés à racines fendues. Physiol. Plantarum 152 , 634–645. https://doi.org/10.1111/ppl.12214 (2014).Article CAS Google Scholar
- Mulholland, BJ et al. Effet du stress salin des racines fendues sur l’expansion des feuilles de tomate, le rendement et la qualité des fruits. J. Hortic. Sci. Biotechnol. 77 , 509–519. https://doi.org/10.1080/14620316.2002.11511531 (2002).Article CAS Google Scholar
- Robert, CAM et al. Un herbivore spécialiste des racines réduit la résistance des plantes et utilise un composé volatil végétal induit pour s’agréger de manière dépendante de la densité. Funct. Ecol. 26 , 1429–1440. https://doi.org/10.1111/j.1365-2435.2012.02030.x (2012).Article Google Scholar
- Iqbal, N. et al. Tolérance à la sécheresse du soja ( Glycine max L. Merr.) par des caractéristiques photosynthétiques améliorées et une activité enzymatique antioxydante efficace sous un système à racines divisées. Front. Physiol. 10 , 786. https://doi.org/10.3389/fphys.2019.00786 (2019).Article PubMed PubMed Central Google Scholar
- Yoneyama, K. et al. Les signaux dérivés des pousses autres que l’auxine sont impliqués dans la régulation systémique de la production de strigolactone dans les racines. Planta 241 , 687–698. https://doi.org/10.1007/s00425-014-2208-x (2015).Article CAS PubMed Google Scholar
- Holbrook, NM, Shashidhar, VR, James, RA & Munns, R. Contrôle stomatique chez la tomate avec racines déficientes en ABA : réponse des plantes greffées au dessèchement du sol. J. Exp. Bot. 53 , 1503–1514. https://doi.org/10.1093/jexbot/53.373.1503 (2002).Article CAS PubMed Google Scholar
- Huntenburg, K., Puértolas, J., de Ollas, C. & Dodd, IC Signalisation hormonale bidirectionnelle à longue distance entre les racines et les pousses de la disponibilité en eau du sol. Physiol. Plant 174 , e13697. https://doi.org/10.1111/ppl.13697 (2022).Article CAS PubMed PubMed Central Google Scholar
- Kafle, A., Frank, HER, Rose, BD et Garcia, K. Split down the middle : étude des symbioses mycorhiziennes et ectomycorhiziennes à arbuscules à l’aide d’essais à racines divisées. J. Exp. Bot. 73 , 1288–1300. https://doi.org/10.1093/jxb/erab489 (2021).Article CAS Google Scholar
- Chrungoo, NK, Dohtdong, L. & Chettry, U. Plasticité du génome chez le sarrasin. Gene Pool Divers. Crop Improv. 1 , 227–239 (2016).Article Google Scholar
- Baraibar, B., Hamilton, A., Hunter, MC, Mortensen, DA et Schipanski, ME Suppression des mauvaises herbes dans les monocultures et les mélanges de cultures de couverture. Weed Sci. 66 , 121–133. https://doi.org/10.1017/wsc.2017.59 (2018).Article Google Scholar
- Haruna, SI et al. Améliorer les propriétés physiques du sol grâce à l’utilisation de cultures de couverture : une revue. Agrosyst. Geosci. Environ. 3 , e20105. https://doi.org/10.1002/agg2.20105 (2020).Article Google Scholar
- Mallinger, RE, Franco, JG, Prischmann-Voldseth, DA & Prasifka, JR. Cultures de couverture annuelles pour les abeilles domestiques et sauvages : les mélanges de plantes optimaux dépendent des objectifs d’amélioration des pollinisateurs. Agric. Ecosyst. Environ. 273 , 107–116. https://doi.org/10.1016/j.agee.2018.12.006 (2019).Article Google Scholar
- Fried, G., Chauvel, B., Reynaud, P. & Sache, I. Dans Impact of Biological Invasions on Ecosystem Services (éd. Vilà, M. & Hulme, PE) 83–101 (Springer International Publishing, 2017).
- Korres, NE et al. Dans Advances in Agronomy vol. 155 (éd. Sparks, DL) 243–319 (Academic Press, 2019).
- Falquet, B., Roux, D., Henriet, L., Tschuy, F. & Wirth, J. Méthode simple pour séparer la compétition entre les ressources des interactions racinaires allélopathiques. Allelopathy J. 34 (2), 227–240 (2014).
- Falquet, B., Gfeller, A., Pourcelot, M., Tschuy, F. & Wirth, J. Suppression des mauvaises herbes par le sarrasin commun : une revue. Environ. Control Biol. 53 , 1–6 (2015).Article CAS Google Scholar
- Gfeller, A., Herrera, JM, Tschuy, F. & Wirth, J. Explications de la suppression de la croissance d’Amaranthus retroflexus par les cultures de couverture. Crop Prot. 104 , 11–20 (2018).Article Google Scholar
- Kalinova, J. & Vrchotova, N. Taux de catéchine, myricétine, quercétine et isoquercitrine dans le sarrasin ( Fagopyrum esculentum Moench), évolution de leurs taux au cours de la végétation et leur effet sur la croissance de mauvaises herbes sélectionnées. J. Agric. Food Chem. 57 , 2719–2725 (2009).Article CAS PubMed Google Scholar
- Kalinova, J., Vrchotova, N. & Triska, J. Exsudation de substances allélopathiques dans le sarrasin ( Fagopyrum esculentum Moench). J. Agric. Food Chem. 55 , 6453–6459 (2007).Article CAS PubMed Google Scholar
- Golisz, A., Lata, B., Gawronski, SW et Fujii, Y. Activités spécifiques et totales des composés allélochimiques identifiés dans le sarrasin. Weed Biol. Manag. 7 , 164–171. https://doi.org/10.1111/j.1445-6664.2007.00252.x (2007).Article CAS Google Scholar
- Gertsman, I. & Barshop, BA Promesses et pièges de la métabolomique non ciblée. J. Inherit. Metab. Dis. 41 , 355–366. https://doi.org/10.1007/s10545-017-0130-7 (2018).Article CAS PubMed PubMed Central Google Scholar
- Schulze, B. et al. Une évaluation des efforts d’assurance qualité/contrôle qualité dans les flux de travail non ciblés de spectrométrie de masse à haute résolution pour l’analyse d’échantillons environnementaux. TrAC Trends Anal. Chem. 133 , 116063. https://doi.org/10.1016/j.trac.2020.116063 (2020).Article CAS Google Scholar
- Schymanski, EL et al. Dépistage non ciblé par spectrométrie de masse à haute résolution : revue critique à l’aide d’un essai collaboratif sur l’analyse de l’eau. Anal. Bioanal. Chem. 407 , 6237–6255. https://doi.org/10.1007/s00216-015-8681-7 (2015).Article CAS PubMed Google Scholar
- Zhalnina, K. et al. La chimie dynamique de l’exsudat racinaire et les préférences microbiennes en matière de substrat déterminent les modèles d’assemblage de la communauté microbienne de la rhizosphère. Nat. Microbiol. 3 , 470–480. https://doi.org/10.1038/s41564-018-0129-3 (2018).Article CAS PubMed Google Scholar
- McLaughlin, S., Zhalnina, K., Kosina, S., Northen, TR & Sasse, J. Le métabolisme central et la dynamique d’exsudation racinaire de trois espèces végétales phylogénétiquement distinctes. Nat. Commun. 14 , 1649 (2023).Article PUBLICITÉS CAS PubMed PubMed Central Google Scholar
- Schymanski, EL et al. Identification de petites molécules par spectrométrie de masse à haute résolution : communiquer la confiance. Environ. Sci. Technol. 48 , 2097–2098. https://doi.org/10.1021/es5002105 (2014).Article PUBLICITÉS CAS PubMed Google Scholar
- Nam, SL, de la Mata, AP, Dias, RP & Harynuk, JJ Vers une standardisation des stratégies de normalisation des données pour améliorer les études de métabolomique urinaire par GC× GC-TOFMS. Metabolites 10 , 376 (2020).Article CAS PubMed PubMed Central Google Scholar
- Ulbrich, TC, Rivas-Ubach, A., Tiemann, LK, Friesen, ML & Evans, SE Les exsudats racinaires des plantes et les communautés bactériennes de la rhizosphère changent en fonction du contexte voisin. Biochimie des sols. 172 , 108753. https://doi.org/10.1016/j.soilbio.2022.108753 (2022).Article CAS Google Scholar
- Montesinos-Navarro, A. et al. La réponse métabolique des plantes au stress dans un écosystème aride est médiée par la présence de voisins. Écologie https://doi.org/10.1002/ecy.4247 (2024).Article PubMed Google Scholar
- Hazrati, H., Fomsgaard, IS et Kudsk, P. La métabolomique ciblée révèle une altération de l’accumulation et de l’exsudation racinaire des flavonoïdes en réponse à la compétition interspécifique. J. Plant Interact. 16 , 53–63. https://doi.org/10.1080/17429145.2021.1881176 (2021).Article CAS Google Scholar
- Oh, E., Seo, PJ et Kim, J. Peptides de signalisation et récepteurs coordonnant le développement des racines des plantes. Trends Plant Sci. 23 , 337–351 (2018).Article CAS PubMed Google Scholar
- Korenblum, E. et al. Le microbiome de la rhizosphère médie l’exsudation systémique des métabolites racinaires par signalisation de racine à racine. Proc. Natl. Acad. Sci. 117 , 3874–3883 (2020).Article PUBLICITÉS CAS PubMed PubMed Central Google Scholar
- Tabata, R. et al. La perception des peptides dérivés des racines par les LRR-RK des pousses médie la signalisation de la demande systémique en N. Science 346 , 343–346 (2014).Article PUBLICITÉS CAS PubMed Google Scholar
- Vieites-Álvarez, Y. et al. Le modèle d’accumulation des métabolites spécialisés dans le sarrasin est fortement influencé par le choix de l’accession et les mauvaises herbes coexistantes. Plantes 12 , 2401 (2023).Article PubMed PubMed Central Google Scholar
- Delory, BM, Callaway, RM et Semchenko, M. Un cadre basé sur les traits reliant le métabolisme du sol aux rétroactions plante-sol. New Phytol. 241 , 1910–1921. https://doi.org/10.1111/nph.19490 (2024).Article CAS PubMed Google Scholar
- Gfeller, V., Thoenen, L. & Erb, M. Les benzoxazinoïdes exsudés par les racines peuvent atténuer les rétroactions négatives plante-sol. New Phytol. 241 , 2575–2588. https://doi.org/10.1111/nph.19401 (2024).Article CAS PubMed Google Scholar
- Sun, L. et al. L’exsudation racinaire comme trait fonctionnel majeur des racines fines compétitives de 18 espèces coexistantes dans une forêt subtropicale. New Phytol. 229 , 259–271. https://doi.org/10.1111/nph.16865 (2021).Article CAS PubMed Google Scholar
- Lynch, JP et al. Anatomie des racines et capture des ressources du sol. Plant Soil 466 , 21–63. https://doi.org/10.1007/s11104-021-05010-y (2021).Article CAS Google Scholar
- Zhang, L. et al. Identification moléculaire d’un activateur spécifique des cellules apicales racinaires et sensible au stress à partir d’une lignée de pièges activateurs d’Arabidopsis. Plant Methods 15 , 8. https://doi.org/10.1186/s13007-019-0393-0 (2019).Article PUBLICITÉS PubMed PubMed Central Google Scholar
- Foxx, AJ & Kramer, AT La variation du nombre d’extrémités de racines influence la survie en compétition avec une herbe envahissante. J. Arid Environ. 179 , 104189. https://doi.org/10.1016/j.jaridenv.2020.104189 (2020).Article PUBLICITÉS Google Scholar
- Proctor, C. & He, Y. Quantification des extraits et exsudats racinaires de carex et d’arbustes en relation avec la morphologie racinaire. Soil Biol. Biochem. 114 , 168–180. https://doi.org/10.1016/j.soilbio.2017.07.006 (2017).Article CAS Google Scholar
- Galindo-Castañeda, T., Hartmann, M. & Lynch, JP Localisation : Architecture racinaire, structures, rhizosphère, associations microbiennes. J. Exp. Bot. 75 , 594–604. https://doi.org/10.1093/jxb/erad421 (2023).Article PubMed Central Google Scholar
- Šoln, K., Žnidaršič, N. & Dolenc Koce, J. Inhibition de la croissance des racines et modifications ultrastructurales des extrémités des racines de radis après traitement avec des extraits aqueux de rhizomes de Fallopia japonica et de F. ×bohemica . Protoplasma 259 , 343–355. https://doi.org/10.1007/s00709-021-01668-4 (2022).Article CAS PubMed Google Scholar
- Šoln, K., Žnidaršič, N., Klemenčič, M. & Koce, JD Les extraits de Fallopia japonica et Fallopia × bohemica provoquent des changements ultrastructuraux et biochimiques dans les extrémités des racines des plants de radis. Physiol. Plantaire 175 , e14032. https://doi.org/10.1111/ppl.14032 (2023).Article CAS Google Scholar
- Wasson, AP et al. Caractéristiques et stratégies de sélection pour améliorer les systèmes racinaires et l’absorption d’eau dans les cultures de blé limitées en eau. J. Exp. Bot. 63 , 3485–3498. https://doi.org/10.1093/jxb/ers111 (2012).Article CAS PubMed Google Scholar
- López-Bucio, J., Cruz-Ramírez, A. & Herrera-Estrella, L. Le rôle de la disponibilité des nutriments dans la régulation de l’architecture racinaire. Curr. Opin. Plant Biol. 6 , 280–287. https://doi.org/10.1016/S1369-5266(03)00035-9 (2003).Article CAS PubMed Google Scholar
- Britschgi, D., Stamp, P. & Herrera, JM Croissance des racines du maïs et des mauvaises herbes voisines étudiées avec des minirhizotrons. Weed Sci. 61 , 319–327 (2013).Article CAS Google Scholar
- Wang, C.-Y., Li, L.-L., Meiners, SJ et Kong, C.-H. Modèles de placement des racines dans les interactions allélopathiques entre plantes. New Phytol. 237 , 563–575. https://doi.org/10.1111/nph.18552 (2023).Article PubMed Google Scholar
- Ryser, P. & Eek, L. Conséquences de la plasticité phénotypique par rapport aux différences interspécifiques dans les caractéristiques des feuilles et des racines pour l’acquisition de ressources aériennes et souterraines. Am. J. Bot. 87 , 402–411. https://doi.org/10.2307/2656636 (2000).Article CAS PubMed Google Scholar
- Gfeller, A., Glauser, G., Etter, C., Signarbieux, C. & Wirth, J. Fagopyrum esculentum modifie son exsudation racinaire après reconnaissance d’Amaranthus retroflexus et supprime la croissance des mauvaises herbes. Front. Plant Sci. 9 , 50. https://doi.org/10.3389/fpls.2018.00050 (2018).Article PubMed PubMed Central Google Scholar
- Gersani, M., Brown, JS, O’Brien, EE, Maina, GM et Abramsky, Z. La tragédie des biens communs en raison de la compétition racinaire. J. Ecol. 89 , 660–669. https://doi.org/10.1046/j.0022-0477.2001.00609.x (2001).Article Google Scholar
- Saiz-Fernández, I., Černý, M., Skalák, J. & Brzobohatý, B. Systèmes à racines divisées : méthodologie détaillée, applications alternatives et implications au niveau du protéome des feuilles. Méthodes végétales 17 , 7. https://doi.org/10.1186/s13007-020-00706-1 (2021).Article CAS PubMed PubMed Central Google Scholar
- Tsugawa, H. et al. Une approche chimioinformatique pour caractériser les métabolomes dans les organismes marqués par des isotopes stables. Nat. Méthodes 16 , 295–298. https://doi.org/10.1038/s41592-019-0358-2 (2019).Article CAS PubMed Google Scholar
Remerciements
Les auteurs remercient Mme Pauline Canelle pour son aide dans la conduite des expériences en laboratoire. Ils remercient tout particulièrement le Prof. Dr. Niko Geldner pour ses commentaires et ses précieuses suggestions. Ce projet a été soutenu par EQ-BOKU VIBT GmbH et BOKU Core Facility Mass Spectrometry.
Financement
Cette étude a été financée par le Fonds national suisse de la recherche scientifique (FNS) (205321L-189174) et le Fonds scientifique autrichien (FWF) I4527-B.
Informations sur l’auteur
Notes de l’auteur
- Ces auteurs ont contribué à parts égales : Çağla Görkem Eroğlu et Alexandra A. Bennett.
Auteurs et affiliations
- Herboristerie en grandes cultures, Systèmes de production végétale, Agroscope, Nyon, SuisseÇağla Görkem Eroğlu, Judith Wirth & Aurélie Gfeller
- Département de chimie, Institut de chimie analytique, Université des ressources naturelles et des sciences de la vie, Vienne (BOKU), 1190, Vienne, AutricheAlexandra A. Bennett, Teresa Steininger-Mairinger et Stephan Hann
- Département des sciences de la forêt et des sols, Institut de recherche sur les sols, Groupe d’écologie et de biogéochimie de la rhizosphère, Université des ressources naturelles et des sciences de la vie, Vienne, Konrad-Lorenz-Strasse 24, 3430, Tulln, AutricheMarkus Puschenreiter
Contributions
Tous les auteurs ont lu et approuvé le manuscrit final. CGE et AB ont réalisé des expériences en laboratoire, des analyses et des analyses de données, et ont préparé les figures. CGE, AB et AG ont contribué à la rédaction du manuscrit, et tous les auteurs ont participé à la révision du manuscrit.
Auteur correspondant
Déclarations éthiques
Intérêts concurrents
Les auteurs ne déclarent aucun conflit d’intérêt.
Informations Complémentaires
Note de l’éditeur
Springer Nature reste neutre à l’égard des revendications juridictionnelles dans les cartes publiées et les affiliations institutionnelles.
Informations complémentaires
Informations complémentaires.
Droits et autorisations
Accès libre Cet article est sous licence Creative Commons Attribution 4.0 International, qui autorise l’utilisation, le partage, l’adaptation, la distribution et la reproduction sur tout support ou format, à condition que vous donniez le crédit approprié à l’auteur(s) d’origine et à la source, que vous fournissiez un lien vers la licence Creative Commons et que vous indiquiez si des modifications ont été apportées. Les images ou autres éléments tiers de cet article sont inclus dans la licence Creative Commons de l’article, sauf indication contraire dans une ligne de crédit du contenu. Si le contenu n’est pas inclus dans la licence Creative Commons de l’article et que votre utilisation prévue n’est pas autorisée par la réglementation statutaire ou dépasse l’utilisation autorisée, vous devrez obtenir l’autorisation directement du détenteur des droits d’auteur. Pour consulter une copie de cette licence, visitez http://creativecommons.org/licenses/by/4.0/ .
Réimpressions et autorisations
À propos de cet article
Citer cet article
Eroğlu, Ç.G., Bennett, AA, Steininger-Mairinger, T. et al. Les changements induits par le voisinage dans les schémas d’exsudation racinaire du sarrasin entraînent une altération de l’architecture racinaire de l’amarante à racine rouge. Sci Rep 14 , 8679 (2024). https://doi.org/10.1038/s41598-024-58687-3
Continuer avec allélopathie :
https://www.nature.com/articles/s41598-024-60663-w
https://www.nature.com/articles/s41598-024-65938-w?fromPaywallRec=false
https://www.nature.com/articles/s41598-022-16203-5?fromPaywallRec=false
https://www.nature.com/articles/s41598-022-24144-2?fromPaywallRec=false

